Martes
30 de Sept de 2014
09:30
- 10:30 Exposiciones de química grado 10°
Descripción:
Responsable:
Wilmar Murillo.
Miércoles 29 de Oct de 2014
Séptima semana del cuarto período
Lugar: Aula 33 (11°A).
Descripción:
Responsable: profesor Luis Fernando Bohórquez y
grupo 11°A. Los estudiantes de 11°A
estarán todo el día socializando los experimentos. Los docentes que tienen
clase con 11°A, acompañan en esas horas al
grupo durante las socializaciones. Nota: requiere servicio de Interpretación.
Cuarta
semana del cuarto período
Novena
semana del cuarto periodo
Viernes
14 de Nov de 2014
Lugar:
Aula
multigrado D
Descripción:
Responsable:
Docente ciencias naturales multigrado D, Física y Química multigrado F.
El compromiso de los
estudiantes y equipo docente, no sólo
fue científico, sino ecológico; todo el año trajeron material reciclable;
actividad ésta, que finalizó el día
viernes 14 de noviembre de 2014.
Desarrollaron capacitación y
charlas grupales, sobre el dengue,
prevención de desastres; igualmente, realizaron
cultivos de jardines, huerto y
salidas pedagógicas al zoológico y universidad de Antioquia de carácter
científicoinvestigativo.
Nociones
físicoquímicas desarrolladas por los estudiantes de la media básica y la técnica,
pertenecientes a las poblaciones, invidentes, sordos, con movilidad reducida, oyentes, talla pequeña
y cognitivos, en los experimentos de final de año:
1. Electromagnetismo



El
electromagnetismo es la parte de la electricidad que estudia la relación
entre los fenómenos eléctricos y los fenómenos magnéticos. Los fenómenos
eléctricos y magnéticos fueron considerados como independientes hasta 1820,
cuando su relación fue descubierta por
casualidad.
Así, hasta esa fecha el magnetismo y la
electricidad había sido tratada como fenómenos distintos y eran estudiados por
ciencias diferentes. Sin embargo, esto cambió a partir del descubrimiento que
realizó Hans Chirstian Oersted, observando que la aguja de una brújula variaba
su orientación al pasar corriente a través de un conductor próximo a ella. Los
estudios de Oersted sugerían que la electricidad y el magnetismo eran
manifestaciones de un mismo fenómeno: las fuerzas magnéticas proceden de las
fuerzas originadas entre cargas eléctricas en movimiento.
El electromagnetismo es la base de funcionamiento
de todos los motores eléctricos y generadores eléctrico.
Orígenes del electromagnetismo: el experimento de
Oersted
Esta relación entre la electricidad y el magnetismo
fue descubierta por el físico danés Hans Christian Øersted. Éste observó que si
colocaba un alfiler magnético que señalaba la dirección norte-sur paralela a un
hilo conductor rectilíneo por el cual no circula corriente eléctrica, ésta no
sufría ninguna alteración.
Sin embargo en el momento en que empezaba a pasar
corriente por el conductor, el alfiler magnético se desviaba y se orientaba
hacia una dirección perpendicular al hilo conductor.
En cambio, si dejaba de pasar corriente por el hilo
conductor, la aguja volvía a su posición inicial.
De este experimento se deduce que al pasar a una
corriente eléctrica por un hilo conductor se crea un campo magnético.
Campo magnético creado por una corriente eléctrica
Una corriente que circula por un conductor genera un
campo magnético alrededor del mismo.
El
valor del campo magnético creado en un punto dependerá de la intensidad
de la corriente eléctrica y de la distancia del punto respecto el
hilo, así como de la forma que tenga el conductor por donde pasa la corriente
eléctrica.
El
campo magnético creado por un elemento de corriente hace que alrededor de este
elemento se creen líneas de fuerzas curvas y cerradas. Para determinar la
dirección y sentido del campo magnético podemos usar la llamada regla de la mano derecha.
La regla de la mano derecha nos dice que
utilizando dicha mano, y apuntando con el dedo pulgar hacia el sentido de la
corriente, la curvatura del resto de dedos nos indicará el sentido del campo
magnético:
- En el caso de un hilo conductor rectilíneo se crea un campo magnético circular alrededor del hilo y perpendicular a él.
- Cuando tenemos un hilo conductor en forma de espira, el campo magnético será circular. La dirección y el sentido del campo magnético depende del sentido de la corriente eléctrica.
- Cuando tenemos un hilo conductor enrollado en forma de hélice
tenemos una bobina o solenoide. El campo magnético en su
interior se refuerza todavía más en existir más espiras: el campo
magnético de cada espira se suma a la siguiente y se concentra en la
región central.
Fuerza electromagnética
Cuando
una carga
eléctrica está en movimiento crea un campo eléctrico y un campo magnético a su
alrededor.
Así
pues, este campo magnético realiza una fuerza sobre cualquier otra carga
eléctrica que esté situada dentro de su radio de acción. Esta fuerza que ejerce
un campo magnético será la fuerza
electromagnética.
Si
tenemos un hilo conductor rectilíneo por donde circula una corriente
eléctrica y que atraviesa un campo magnético, se origina una fuerza electromagnética sobre el
hilo. Esto es debido a que el campo magnético genera fuerzas sobre cargas eléctricas
en movimiento.
Si
en lugar de tener un hilo conductor rectilíneo tenemos un espiral rectangular,
aparecerán un par de
fuerzas de igual valor pero de diferente sentido situadas sobre
los dos lados perpendiculares al campo magnético. Esto no provocará un
desplazamiento, sino que la espira girará
sobre sí misma.
Ley de Charles
LA FÍSICA DEL BUCEO, LEY DE CHARLES

Pon el globo entre los dos objetos del paso 1. No muevas los objetos. Debería haber espacio de sobra entre el globo y los objetos. El volumen del globo ha disminuido porque el aire en el globo está más frío de lo que estaba inicialmentehttp://es.wikihow.com/demostrar-la-ley-de-Charles
La Ley de Charles y
Gay-Lussac, o simplemente Ley de Charles, es una de las leyes de los gases . Relaciona el volumen y la temperatura
de una cierta cantidad de gas ideal, mantenida a una presión
constante, mediante una constante de proporcionalidad directa.
LEY APLICABLE AL BUCEO:
Ley de Charles-Gay Lussac.-
A volumen constante, el incremento de presión de un gas, es proporcional al
incremento de su temperatura. Mientras que a Presión constante, el Volumen de
un gas es directamente proporcional a la temperatura.
P / T = Cte. P / T = P' / T' V / T = Cte. V / T = V' /
T'
Esta Ley más que al
buceador, cuya temperatura se mantiene constante, afecta a los mecanismos que
utiliza, que están sometidos a diferencias de temperatura ambiental
(variaciones de presión en el llenado de botellas, etc...).
Como aplicación de las dos
Leyes nos resulta la Ecuación General de los Gases que se expresa
matemáticamente de la siguiente forma:
P x V P' x V'
------- = ---------
T T'
El volumen de un gas o masa
de gases experimenta variaciones en razón directamente proporcional a la
presión que soporta.
En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presión constante, al
aumentar la temperatura, el volumen del gas aumenta y al disminuir la
temperatura, el volumen del gas disminuye. Esto se debe a que la temperatura
está directamente relacionada con la energía cinética (debido al movimiento) de las moléculas del gas.
Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de
las moléculas (temperatura), mayor volumen del gas.
En esta ley, Jacques
Charles dice que para una cierta cantidad de gas a una presión
constante, al aumentar la temperatura, el volumen del gas aumenta y al
disminuir la temperatura, el volumen del gas disminuye. Esto se debe a que la
temperatura está directamente relacionada con la energía cinética (debido al movimiento)
de las moléculas del gas. Así que, para cierta cantidad de gas a una presión
dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.
La ley fue publicada primero
por Gay Lussac
en 1803 ,
pero hacía referencia al trabajo no publicado de Jacques Charles, de alrededor
de 1787 ,
lo que condujo a que la ley sea usualmente atribuida a Charles. La relación
había sido anticipada anteriormente en los trabajos de Guillaume Amontons en 1702 .
Por otro lado, Gay-Lussac
relacionó la presión y la temperatura como magnitudes
directamente proporcionales en la llamada "La
segunda ley de Gay-Lussac" .
Volumen sobre temperatura:
Constante (K -en referencia a si mismo) o también:
Dónde:
- V es el volumen.
- T es la temperatura absoluta (es decir,
medida en Kelvin ).
- k2 es la constante de proporcionalidad.
Además puede expresarse como:
Dónde:
Despejando T₁ se obtiene:
Despejando T₂ se obtiene:
Despejando V₁ es igual a:
Despejando V₂ se obtiene:
Un buen experimento para
demostrar esta ley es el de calentar una lata con un poco de agua, al hervir el
agua se sumerge en agua fría y su volumen cambia.
3. La capilaridad

https://sites.google.com/site/leyes11polmiguel/2-propiedades-de-los-liquidos-y-gases/2-3-capilaridad
Es un
proceso de los fluidos
que depende de su tensión superficial la cual, a su vez, depende
de la cohesión del líquido y que le confiere la capacidad de subir o bajar por
un tubo capilar.
Cuando un líquido sube por un
tubo capilar, es debido a que la fuerza intermolecular o cohesión
intermolecular entre sus moléculas es menor que la adhesión
del líquido con el material del tubo; es decir, es un líquido que moja.
El líquido sigue subiendo hasta que la tensión superficial es equilibrada por
el peso del líquido que llena el tubo. Éste es el caso del agua, y esta propiedad es
la que regula parcialmente su ascenso dentro de las plantas,
sin gastar energía para vencer la gravedad.
Sin embargo, cuando la
cohesión entre las moléculas de un líquido es más potente que la adhesión al
capilar, como el caso del mercurio, la tensión superficial hace que el
líquido descienda a un nivel inferior y su superficie es convexa.
La masa líquida es
directamente proporcional al cuadrado del diámetro del tubo, por lo que un tubo
angosto succionará el líquido en una longitud mayor que un tubo ancho. Así, un
tubo de vidrio de 0,1 mm de diámetro levantará una columna de agua de
30 cm. Cuanto más pequeño es el diámetro del tubo capilar mayor será la presión capilar
y la altura alcanzada. En capilares de 1 µm (micrómetro) de radio,
con una presión de succión 1,5 × 103 hPa
(hectopascal = hPa = 1,5 atm), corresponde a una altura de columna de
agua de 14 a 15 m.
Dos placas de vidrio que están
separadas por una película de agua de 1 µm de espesor, se mantienen unidas
por una presión
de succión de 1,5 atm. Por ello se rompen los portaobjetos humedecidos al
intentar separarlos.
Entre algunos materiales, como
el mercurio y el vidrio, las fuerzas intermoleculares del líquido exceden a las
existentes entre el líquido y el sólido, por lo que se forma un menisco convexo
y la capilaridad trabaja en sentido inverso.
Las plantas
succionan agua subterránea del terreno por capilaridad, aunque las plantas más
grandes requieren.
Bibliografía
Podemos clasificar la materia por el tipo de
componentes que contiene, por tanto podemos subdividirla en Sustancias Puras y
Mezclas.
4. Sustancias Puras:
Formadas por un solo tipo de sustancia, poseen una
composición fija o definida en los diferentes estados físicos de la materia
(Líquido, sólido y gaseoso), presentan propiedades características, como la
temperatura de ebullición (específica y constante) o la densidad. Estas pueden
ser, los elementos y compuestos químicos.
a) Elementos Químicos: Sustancias simples
compuestas por un solo tipo de partículas (átomos) y no se pueden descomponer
en otras sustancias más sencillas. Se representan mediante símbolos en la tabla
periódica (Figura 1), por ejemplo el Oxígeno (O), el Zinc (Zn), el cobre (Cu),
el carbono (C), el sodio (Na), entre otros.
Al unirse dos o más átomos iguales, éstos formarán
moléculas, tales como el Ozono (O3) o el Nitrógeno gaseoso (N2).
b) Compuestos Químicos: Unión de dos o más
sustancias (átomos) diferentes, en cantidades fijas y exactas. Se pueden
descomponer en sustancias más simples a través de métodos químicos. Se
representan mediante fórmulas químicas que expresan las cantidades y tipos de
elementos químicos que los componen.
5. Mezclas:
Combinación de dos o más sustancias puras, que pueden estar en cantidades
variables conservando sus propiedades individuales. Sus componentes pueden ser
separados u obtenidos mediante métodos físicos. Se clasifican en Mezclas
Homogéneas y Mezclas Heterogéneas.
a) Mezclas Homogéneas: Son mezclas cuyos componentes se encuentran
distribuidos de manera uniforme o en una fase y no se pueden distinguir a
simple vista. Se denominan también Diluciones Químicas, ya que se encuentran
formadas por soluto (que está en menor proporción) y un disolvente (líquido
mayoritariamente) que se encuentra en mayor proporción en una solución.
Ejemplos: El vinagre (Solución líquida), el aire (solución gaseosa), el agua
con sal después de ser revuelto (solución líquida), el Acero (Solución sólida),
el agua potable (solución líquida), Jabón (Solución sólida), entre otros.
b) Mezclas Heterogéneas: En ellas se pueden
observar a simple vista o con instrumentos de laboratorio los componentes que
la constituyen, porque estos se distribuyen en forma irregular o en fases
(figura 4). Dentro de éstas se encuentran los Coloides y las
Suspensiones:
- Suspensiones: Son mezclas en donde una
sustancia o partícula es visible en una solución, porque esta no se disuelve en
un medio líquido o solvente. Ejemplos: Sangre, jugos de frutas naturales, polvo
en el aire, entre otros.
- Coloides: Son mezclas que poseen partículas muy pequeñas,
que sólo son vistas con un buen microscopio electrónico, se encuentran en
constante movimiento y choque entre ellas en el medio que las contiene.
Ejemplos: Leche, Jalea, Mayonesa, Aceite emulsionado, entre otros.
Para profundizar:
Una sustancia es una forma de materia que
tiene una composición definida (constante) y propiedades características.
·
Ejemplos: El agua, El amoniaco, el azúcar
(sacarosa), el oro, y el oxígeno.
Las
sustancias difieren entre sí en su composición y pueden identificarse por su
apariencia, olor, sabor y otras propiedades.
·
Ejemplos: El Aire, las bebidas gaseosas, la leche y
el cemento.
Las
mezclas no tienen una composición constante, por
tanto, las muestras de aire recolectadas de varias ciudades probablemente tendrán
una composición distinta debido a sus diferencias en altitud y contaminación,
entre otros factores.
Las
mezclas pueden ser homogéneas o heterogéneas. cuando
una cucharada de azúcar se disuelve en agua, obtenemos una mezcla homogénea, es decir, la composición de la mezcla es la
misma en toda disolución. Sin embargo si se juntan arena y
virutas de hierro permanecerán como tales. este tipo de mezcla se conoce
como mezcla heterogénea debido a que su composición es uniforme.
Cualquier mezcla, ya sea homogénea o heterogénea,
se puede formar y volver a separar en sus componentes puros por medios físicos,
sin cambiar la identidad de dichos componentes. así, el
azúcar se puede separar de la disolución acuosa al calentar y evaporar la disolución
hasta que se seque. si se condensa el vapor de agua liberado, es posible
obtener el componente agua. para separar los componentes de la mezcla de hierro
y arena, se puede utilizar un imán para recuperar las virutas de hierro, ya que
el imán no atrae a la arena. después de la separación, no habrá ocurrido cambio
alguno en las propiedades de los componentes de la mezcla.
Bibliografía
http://www.tplaboratorioquimico.com/2008/12/sustancias-y-mezclas.html
La presión de un gas se origina por el choque
de sus moléculas con las paredes del recipiente que lo contiene. Cuantas más
moléculas choquen mayor será la presión y cuanto más rápido se muevan (que es
lo mismo que estar a mayor temperatura), mayor será la presión.
A
continuación puedes ver el comportamiento de dos gases. Observa que la presión
sólo cambia si modificas la temperatura del gas (las moléculas se mueven más
deprisa) o si aumentas el número de moléculas (se producen más choques). Si
aumentas la masa de las moléculas, la presión no cambia, ya que las moléculas
se mueven más lentamente.
Si
haces que la presión no cambie (pulsando sobre el botón correspondiente)
observarás el mismo efecto con el volumen: sólo cambia si aumentas el número de
moléculas o su temperatura, si cambias la masa de las moléculas el volumen
permanece constante.
Es
la medida del efecto de la distribución de fuerzas normales (perpendiculares)
aplicada sobre una superficie o área.
Para
una fuerza dada, la presión obtenida sobre un área pequeña será mayo si se
ejerce sobre una superficie grande, debido a su distribución.
Unidades
de la Presión: por definición de presión, la unidad será el cociente de unidad
de fuerza por unidad de área.
En
el Sistema Internacional de Unidades (S.I.) es: Newton / m2, denominado Pascal
(Pa).
En
el sistema técnico se utilizan: g-f / cm2, Kg-f / cm2, Lb-f / pulg2 = Psi
(Sistema Técnico inglés).
Existen
otras unidades convencionales para medir presión de fluidos (líquido o un gas).
Para medir presiones pequeñas, como ocurre normalmente en el laboratorio, se
utiliza el milímetro de mercurio (mmHg) o Torricelli (Torr).
Cuando
se desea medir presiones elevadas se utiliza la atmosfera (atm). Una atmósfera,
es la presión que ejerce sobre su base una columna de mercurio de 76 cm de
altura.
Ejemplo:
Consideremos
la acción debido al peso de un fluido sobre un área, de tal modo que dicho peso
en concentra en 8 fuerzas perpendiculares, cada una de ellas igual a 5 Newton.
¿Cuál es la presión que ejerce el fluido si el área es de 10 m2?
Solución:
La
presión del fluido es: P = 40 N / 10 m2 = 4 Pa Es la
medida del efecto de la distribución de fuerzas normales (perpendiculares)
aplicada sobre una superficie o área.
Para una fuerza dada, la presión obtenida sobre un
área pequeña será mayo si se ejerce sobre una superficie grande, debido a su
distribución.
7. Unidades de la Presión:
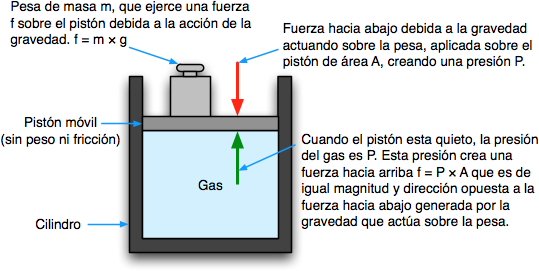

http://www.textoscientificos.com/quimica/gases/presion-gas
por definición de presión, la unidad será el
cociente de unidad de fuerza por unidad de área.
En el Sistema Internacional de Unidades (S.I.) es:
Newton / m2, denominado Pascal (Pa)
En el sistema técnico se utilizan: g-f / cm2,
Kg-f / cm2, Lb-f / pulg2 = Psi (Sistema Técnico inglés)
Existen otras unidades convencionales para medir
presión de fluidos (líquido o un gas). Para medir presiones pequeñas, como
ocurre normalmente en el laboratorio, se utiliza el milímetro de mercurio
(mmHg) o Torricelli (Torr).
Cuando se desea medir presiones elevadas se utiliza
la atmosfera (atm). Una atmósfera, es la presión que ejerce sobre su
base una columna de mercurio de 76 cm de altura.
Ejemplo:
Consideremos la acción debido al peso de un fluido
sobre un área, de tal modo que dicho peso en concentra en 8 fuerzas
perpendiculares, cada una de ellas igual a 5 Newton. ¿Cuál es la presión que
ejerce el fluido si el área es de 10 m2?
Solución:
La presión del fluido es: P = 40 N / 10 m2
= 4 Pa
Bibliografía:
Se identifica con el nombre de
termodinámica a la rama de la física que hace foco en el estudio de los
vínculos existentes entre el calor y las demás variedades de energía. Analiza,
por lo tanto, los efectos que poseen a nivel macroscópico las modificaciones de
temperatura, presión, densidad, masa y volumen en cada sistema.
Es importante subrayar que existe
una serie de conceptos básicos que es fundamental conocer previamente a
entender cómo es el proceso de la termodinámica. En este sentido uno de ellos
es el que se da en llamar estado de equilibrio que puede definirse como aquel
proceso dinámico que tiene lugar en un sistema cuando tanto lo que es el
volumen como la temperatura y la presión no cambian.
De la misma forma está lo que se
conoce por el nombre de energía interna del sistema. Esta se entiende como la
suma de lo que son las energías de todas y cada una de las partículas que
conforman aquel. En este caso, es importante subrayar que dichas energías sólo
dependen de lo que es la temperatura.
El tercer concepto que es
fundamental que conozcamos antes de conocer cómo es el proceso de la
termodinámica es el de ecuación de estado. Una terminología con la que viene a
expresarse la relación que existe entre lo que es la presión, la temperatura y
el volumen.
La base de la termodinámica es todo
aquello que tiene relación con el paso de la energía, un fenómeno capaz de
provocar movimiento en diversos cuerpos. La primera ley de la termodinámica,
que se conoce como el principio de conservación de la energía, señala que, si
un sistema hace un intercambio de calor con otro, su propia energía interna se
transformará. El calor, en este sentido, constituye la energía que un sistema
tiene que permutar si necesita compensar los contrastes surgidos al comparar el
esfuerzo y la energía interior.
La segunda ley de la termodinámica
supone distintas restricciones para las transferencias de energía que, en
hipótesis, podrían llevarse a cabo si se tiene en cuenta la primera ley. El
segundo principio sirve como regulador de la dirección en la que se llevan a
cabo los procesos termodinámicos e impone la imposibilidad de que se
desarrollen en sentido opuesto.
Cabe destacar que esta segunda ley
se respalda en la entropía, una magnitud física encargada de medir la cantidad
energía inservible para generar trabajo.
La tercera ley contemplada por la
termodinámica, por último, destaca que no es posible lograr una marca térmica
que llegue al cero absoluto a través de una cantidad finita de procedimientos
físicos.
Entre los procesos termodinámicos,
se destacan los isotérmicos (no cambia la temperatura), los isócoros (no cambia
el volumen), los isobáricos (no cambia la presión) y los adiabáticos (no hay
transferencia de calor).
http://es.wikipedia.org/wiki/Termodin%C3%A1mica
9. Fuerza
https://www.google.com.co/search?biw=1280&ih=923&soburce=lnms&tbm=isch&sa=X&ei=iNloVLC0M4ehgwSpkIGAAw&ved=0CAYQ_AUoAQ&q=2.%20Animaci%C3%B3n:%20presi%C3%B3n%20y%20masa%20constantes%20Ley%20de%20Charles#tbm=isch&q=FUERZA++en+fisica+y+quimica&facrc=_&imgdii=_&imgrc=rJdYj4Fn-FmMJM%253A%3BsqI9Y2fuOFnRdM%3Bhttps%253A%252F%252Flh4.googleusercontent.com%252F-IigBJvZ0ve8%252FTr7bNW6g8nI%252FAAAAAAAAC6A%252FaoIurmj7h7A%252Fs400%252Fsuma%25252520vectorial%25252520de%25252520fuerzas.png%3Bhttp%253A%252F%252Fblog.educastur.es%252Feureka%252F4%2525C2%2525BA-fyq%252Fdinamica%252F%3B400%3B170
Qué es una fuerza en química o física
Es una magnitud física que mide la
intensidad del intercambio de momento lineal entre dos partículas o sistemas de
partículas y es todo agente capaz de modificar la cantidad de movimiento o la
forma de los cuerpos materiales =)
DINÁMICA
CONCEPTO DE FUERZA. TIPOS.
La fuerza se puede definir desde el
punto de vista dinámico como la causa capaz de modificar el estado de reposo o
movimiento de un cuerpo.
También se puede definir como la
causa capaz de producir deformaciones en los sistemas sobre los que actúa.
Lo mismo que las magnitudes
velocidad y aceleración, vistas anteriormente la fuerza es una magnitud
vectorial.
Las fuerzas pueden ser de dos tipos,
de contacto o a distancia.
Fuerzas de contacto son aquellas que
actúan solamente cuando es necesario el contacto físico entre los elementos que
interaccionan. Ejemplo: cuando se golpea una pelota con una raqueta.
Fuerzas a distancia se producen sin
necesidad de contacto físico entre los cuerpos que interaccionan. Ejemplo: la
fuerza que ejerce la Tierra sobre un cuerpo y que hace que tienda a caer sobre
ella si se encuentra en el aire. Esa fuerza se llama peso.
Bibliografía
Figura 4. Origen de las fuerzas de London.
Cuando
examinamos los puntos de ebullición de varios grupos de moléculas no polares
pronto se hace evidente el efecto del número de electrones (Tabla 2). Este efecto
también se correlaciona con la masa molar: cuanto más pesado es un átomo o
molécula más electrones tiene: Resulta interesante que la forma molecular
también puede desempeñar un papel en la formación de las fuerzas de London.
Dos
de los isómeros del pentano –el pentano de cadena lineal y el
2,2-dimetilpropano (ambos con la fórmula molecular C5H12)-
difieren en su punto de ebullición en 27 ºC. La forma lineal de la molécula de n-pentano,
por su linealidad, permite un contacto estrecho con las moléculas adyacentes,
mientras que la molécula de 2,2-dimetilpropano, más esférica no permite ese
contacto.
Tabla
2. Efecto del número de electrones sobre el punto de ebullición de sustancias
no polares
Gases
nobles
|
Halógenos
|
Hidrocarburos
|
|||||||||
NºElec
|
P.A
|
P.E.ºC
|
NºElec
|
P.M
|
P.E.ºC
|
NºElec
|
P.M
|
P.E.ºC
|
|||
He
|
2
|
4
|
-269
|
F2
|
18
|
38
|
-188
|
CH4
|
10
|
16
|
-161
|
Ne
|
10
|
20
|
-246
|
Cl2
|
34
|
71
|
-34
|
C2H6
|
18
|
30
|
-88
|
Ar
|
18
|
40
|
-186
|
Br2
|
70
|
160
|
59
|
C3H8
|
26
|
44
|
-42
|
Kr
|
36
|
84
|
-152
|
I2
|
106
|
254
|
184
|
C4H10
|
34
|
58
|
0
|
Atracciones
dipolo-dipolo
Una atracción dipolo-dipolo es una interacción no covalente entre dos moléculas polares o dos grupos polares de la misma molécula si ésta es grande. En la sección anterior explicamos cómo se forman moléculas que contienen dipolos permanentes cuando se enlazan simétricamente con átomos con electronegatividad diferente. Las moléculas que son dipolos se atraen entre sí cuando la región positiva de una está cerca de la región negativa de la otra (figura 5).
Figura 5. Atracciones dipolo-dipolo (líneas punteadas) entre moléculas de BrCl.
En
un líquido las moléculas están muy cercanas entre sí y se atraen por sus
fuerzas intermoleculares. Las moléculas deben tener suficiente energía para
vencer esas fuerzas de atracción, y hacer que el líquido pueda entrar en
ebullición.
Si se requiere más energía para vencer las atracciones de las
moléculas del líquido A que aquéllas entre las moléculas del líquido B, el
punto de ebullición de A es más alto que el de B. Recíprocamente, menores
atracciones intermoleculares dan pie a puntos de ebullición más bajos.
Puentes de
hidrógeno
Es
un tipo especial de interacción dipolo-dipolo entre el átomo de hidrógeno que
está formando un enlace polar, tal como N—H, O—H, ó F—H, y un átomo
electronegativo como O, N ó F. Esta interacción se representa de la forma
siguiente:
A—H•••B
A—H•••A
A
y B representan O, N ó F; A—H es una molécula o parte de una molécula y B es
parte de otra. La línea de puntos representa el enlace de hidrógeno.
La
energía media de un enlace de hidrógeno es bastante grande para ser una
interacción dipolo-dipolo (mayor de 40 KJ/mol). Esto hace que el enlace de
hidrógeno sea una de gran importancia a la hora de la adopción de determinadas
estructuras y en las propiedades de muchos compuestos.
Las
primeras evidencias de la existencia de este tipo de interacción vinieron del
estudio de los puntos de ebullición. Normalmente, los puntos de ebullición de
compuestos que contienen a elementos del mismo grupo aumentan con el peso
molecular. Pero, como se puede observar en la Figura 6, los compuestos de los
elementos de los Grupos 15, 16 y 17 no siguen esta norma. Para cada uno de los
grupos, los compuestos de menos peso molecular (NH3, H2O,
HF) tienen el punto de ebullición más alto, en contra de lo que se podría
esperar en principio. Ello es debido a que existe algún tipo de interacción
entre las moléculas en estado líquido que se opone al paso al estado de vapor.
Esa interacción es el enlace de hidrógeno, y afecta a los primeros miembros de
la serie pues son los más electronegativos, y por ello el enlace X-H es el más
polarizado, lo que induce la mayor interacción por puente de hidrógeno.
Los
puentes de hidrógeno son especialmente fuertes entre las moléculas de agua y
son la causa de muchas de las singulares propiedades de esta sustancia. Los
compuestos de hidrógeno de elementos vecino al oxígeno y de los miembros de su
familia en la tabla periódica, son gases a la temperatura ambiente: CH4,
NH3, H2S, H2Te, PH3, HCl. En
cambio, el H2O es líquido a la temperatura ambiente, lo que indica
un alto grado de atracción intermolecular. En la figura 6 se puede ver que el
punto de ebullición del agua es 200 ºC más alto de lo que cabría predecir si no
hubiera puentes de hidrógeno.
Los puentes de hidrógeno juegan también un papel
crucial en la estructura del ADN, la molécula que almacena la herencia genética
de todos los seres vivos.
Figura 6. Variación de los puntos de ebullición de los hidruros moleculares.


























































































































































































